
Back تفاعل ألدول Arabic Aldolová reakce Czech Aldolreaktion German Aldol reaction English Reacción aldólica Spanish واکنش آلدول Persian Aldoliadditio Finnish תגובה אלדולית HE Reaksi aldol ID Reazione aldolica Italian
L'aldolisation (appelée aussi cétolisation dans le cadre des cétones) est une réaction de formation de liaisons carbone-carbone importante en chimie organique[1],[2],[3]. Elle implique généralement l'addition nucléophile d'un énolate sur un aldéhyde (ou une cétone), pour former une β-hydroxycétone ou aldol (aldehyde + alcool), une unité structurale présente dans de nombreuses molécules naturelles et médicaments[4],[5],[6]. Parfois, le produit de l'addition aldolique perd une molécule d'eau durant la réaction, pour former une cétone α,β-insaturée. Ceci peut avoir lieu notamment lorsque le produit final est particulièrement stable et le processus (aldolisation + élimination) est appelé crotonisation[7].
La réaction d'aldolisation fut découverte indépendamment par Charles Adolphe Wurtz[8],[9],[10] et Alexandre Porfirievitch Borodine en 1872. Borodine observa la dimérisation du 3-hydroxybutanal avec de l'éthanal (acétaldéhyde) en milieu acide. L'aldolisation est utilisée à grande échelle dans la production de produits chimiques tels que le pentaérythritol[11] et dans l'industrie pharmaceutique pour l'obtention de produits optiquement purs. Par exemple, le chemin de synthèse initial de Pfizer pour le médicament Lipitor (atorvastatine) approuvé en 1996 employait deux réactions aldol[12],[13].
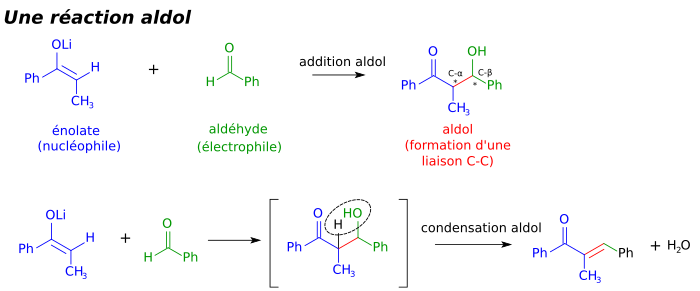
La structure aldol est particulièrement fréquente dans les polycétides, une catégorie de produits naturels à partir de laquelle de nombreux médicaments sont dérivés. Ceux-ci comprennent entre autres l'immunosuppresseur Tacrolimus, l'antibiotique tétracycline et l'antifongique amphotéricine B. Des recherches considérables sur la réaction d'aldolisation ont permis le développement de méthodes efficaces pour la synthèse en laboratoire, autrement ardue, de nombreux polycétides[14]. Ceci est important car beaucoup de polycétides, de même que d'autres molécules biologiquement actives, ne se rencontrent dans la nature qu'en des quantités trop infimes pour une recherche poussée. La synthèse de nombre de ces composés, considérée un temps comme quasi impossible, peut maintenant être effectuée couramment à l'échelle du laboratoire, et approche la viabilité économique dans certains cas, comme le discodermolide, un agent anti-tumoral hautement actif. En biochimie, la réaction d'aldolisation est également une étape-clé de la glycolyse, durant laquelle elle est catalysée par des enzymes appelées aldolases.
La réaction d'aldolisation est particulièrement importante en synthèse organique car elle donne des produits possédant deux nouveaux centres de chiralité (les carbones α et β de l'aldol produit, marqués par des astérisques sur l'image plus haut). Des méthodes récentes permettent désormais le contrôle relatif et absolu de ces centres. Ceci est d'une importance toute particulière dans la synthèse de médicaments, puisque des molécules de même structure mais de stéréochimies différentes ont souvent des propriétés chimiques et biologiques différentes.
Une grande variété de nucléophiles différents peuvent être employés pour la réaction d'aldolisation, incluant les énols, éthers d'énol, et énolates de cétones, d'aldéhydes et d'une grande variété d'autres composés carbonylés. L'électrophile est généralement un aldéhyde, mais de nombreuses variations existent, comme la réaction de Mannich. Quand le nucléophile et l'électrophile sont différents (majorité des cas), la réaction est appelée une aldolisation croisée, contrairement aux dimères formés dans une aldolisation où le même composé joue le rôle d'électrophile et de nucléophile.

Les deux erlenmeyers sont plongés dans un bain de neige carbonique/acétone (−78 °C). La température est contrôlée par un thermocouple (le fil sur la gauche).
- (en) L. G. Wade, Organic Chemistry, Upper Saddle River (New Jersey), Prentice Hall, 2005 (6e éd.) (ISBN 978-0-13-169957-1 et 0-13-169957-1), p. 1056-1066.
- (en) M. B. Smith, J. March, Advanced Organic Chemistry, New York, Wiley Interscience, 2001 (5e éd.) (ISBN 978-0-471-58589-3 et 0-471-58589-0), p. 1218–1223.
- (en) R. Mahrwald, Modern Aldol Reactions, Volumes 1 et 2, Weinheim (Allemagne), Wiley-VCH Verlag GmbH & Co. KGaA, (ISBN 3-527-30714-1), p. 1218–1223.
- (en) C. H. Heathcock, Comp. Org. Syn., Oxford, Pergamon, (ISBN 0-08-040593-2), p. 133–179.
- (en) T. Mukaiyama, « The Directed Aldol Reaction », Org. React., vol. 28, , p. 203-331.
- (en) I. Paterson, « New Asymmetric Aldol Methodology Using Boron Enolates », Chem. Ind., vol. 12, , p. 390-394.
- (en) Stanley H. Pine, Organic Chemistry, McGraw-Hill Book Co., 1987 (ISBN 0-07-100242-1).
- Charles-Adolphe Wurtz, « Sur un aldéhyde-alcool », Bull. Soc. Chim. Fr., vol. 17, , p. 436-442 (lire en ligne, consulté le ).
- Charles-Adolphe Wurtz, « Ueber einen Aldehyd-Alkohol », Journal für praktische Chemie, vol. 5, no 1, , p. 457-464.
- Charles-Adolphe Wurtz, « Sur un aldéhyde-alcool », Comp. Rend., vol. 74, , p. 1361 (lire en ligne).
- (en) R. Mestres, « A green look at the aldol reaction », Green Chemistry, vol. 12, , p. 583–603.
- (en) M. Braun et R. Devant, « (R) and (S)-2-acetoxy-1,1,2-triphenylethanol - effective synthetic equivalents of a chiral acetate enolate », Tetrahedron Letters, vol. 25, , p. 5031–5034.
- (en) Jie Jack Li et al., Contemporary Drug Synthesis, Wiley-Interscience, (ISBN 0-471-21480-9), p. 118.
- (en) B. Schetter et R. Mahrwald, « Modern Aldol Methods for the Total Synthesis of Polyketides », Angewandte Chemie Int. Ed., vol. 45, , p. 7506–7525.