
Back CRISPR Afrikaans كريسبر Arabic ক্রিস্পার Bengali/Bangla CRISPR Catalan CRISPR Czech CRISPR Welsh CRISPR Danish CRISPR German CRISPR Greek CRISPR English
| CRISPR | |
|---|---|

| |
| CRISPR + fragmentos de ADN de E.Coli. | |
| Identificadores | |
| Organismo | |
| Símbolo | ? |
| Otros datos | |
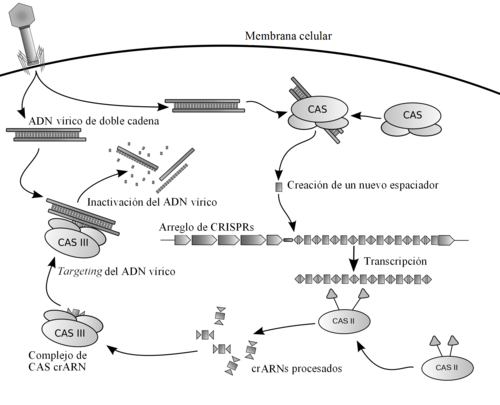
CRISPR (en inglés: Clustered Regularly Interspaced Short Palindromic Repeats, en español: repeticiones palindrómicas cortas agrupadas y regularmente interespaciadas[2]) es una familia de secuencias de ADN de origen viral que se encuentran integradas en el genoma de los organismos procariotas. Dichas secuencias consisten en fragmentos de ADN de virus bacteriófagos que han infectado a bacterias y arqueas en el pasado y que estas han incluido en su propio código genético. Estos fragmentos son utilizados por la célula procariota en el futuro para detectar y destruir el material genético de virus infecciosos similares mediante proteínas que, con base en las secuencias integradas de ataques anteriores, reconocen y cortan el nuevo ADN viral dejándolo inutilizado, funcionando como un sistema inmunitario de defensa procariota eficaz y altamente específico. Además de jugar un papel clave en los sistemas de defensa bacterianos, estas secuencias formaron la base de una revolucionaria tecnología de vanguardia conocida como CRISPR/Cas, que es capaz de modificar los genes de cualquier organismo utilizando una familia de enzimas con actividad endonucleasa asociadas a CRISPR conocidas como Cas, tal como la Cas9 del sistema CRISPR/Cas9.
En términos más técnicos, los arreglos CRISPR son loci de ADN que contienen repeticiones cortas de secuencias de bases. Tras cada repetición siguen segmentos cortos de "ADN espaciador" proveniente de exposiciones previas a un virus.[3] Se encuentran en aproximadamente el 40% de los genomas bacterianos y en el 90% de los genomas secuenciados de las arqueas.[4][5] Con frecuencia se hallan asociados con los genes cas que codifican para proteínas nucleasas conocidas como Cas relacionadas con los CRISPR. El sistema CRISPR/Cas es un sistema inmunitario procariótico que confiere resistencia a agentes externos como plásmidos y bacteriófagos[6][7] y provee una forma de inmunidad adquirida. Los espaciadores de los CRISPR reconocen secuencias específicas y guían a las nucleasas Cas para cortar y degradar esos elementos génicos exógenos de una manera análoga al ARNi en sistemas eucarióticos.[3]
Desde 2013 el sistema CRISPR/Cas se ha utilizado para la edición de genes (agregando, interrumpiendo o cambiando las secuencias de genes específicos) y para la regulación génica en varias especies.[8] Al administrar la proteína Cas9 y los ARN guía apropiados a una célula, el genoma de esta puede cortarse en los lugares deseados, cuyas secuencias serán complementarias a las de los ARN guía utilizados. Esto permite la eliminación funcional de genes o la introducción de mutaciones (tras la reparación del corte realizado por la maquinaria celular de reparación del ADN) para estudiar sus efectos. Modificaciones recientes del sistema CRISPR/Cas9 permiten también actuar sobre la transcripción de los genes, modificando así solo su nivel de funcionamiento, pero no la información genética. Los investigadores plantean que los CRISPRs quizás puedan usarse para construir sistemas de entrega de genes guiados por ARN que lleguen a alterar los genomas de poblaciones enteras.[9]
- ↑ Horvath, P.; Barrangou, R. (2010). «CRISPR/Cas, the Immune System of Bacteria and Archaea». Science 327 (5962): 167-170. PMID 20056882. doi:10.1126/science.1179555.
- ↑ «Flores, J. (2016, enero 5). Los orígenes bacterianos de la edición del genoma. La Jornada, sección Ciencias, p. 3a, suplemento La Jornada de enmedio. México: DEMOS. (Consultado 6 de enero del 2016)». Consultado el 5 de abril de 2017.
- ↑ a b Marraffini LA, Sontheimer EJ (March 2010). «CRISPR interference: RNA-directed adaptive immunity in bacteria and archaea». Nature Reviews Genetics 11 (3): 181-190. PMC 2928866. PMID 20125085. doi:10.1038/nrg2749.
- ↑ CRISPRdb 71/79 Archaea, 463/1008 Bacteria Archivado el 16 de mayo de 2015 en Wayback Machine., Date: 19.6.2010
- ↑ Grissa, I.; Vergnaud, G.; Pourcel, C (2007). «The CRISPRdb database and tools to display CRISPRs and to generate dictionaries of spacers and repeats». BMC Bioinformatics 8: 172. PMC 1892036. PMID 17521438. doi:10.1186/1471-2105-8-172.
- ↑ Barrangou, R.; Fremaux, C.; Deveau, H.; Richards, M.; Boyaval, P.; Moineau, S.; Romero, D. A.; Horvath, P. (2007). «CRISPR Provides Acquired Resistance Against Viruses in Prokaryotes». Science 315 (5819): 1709-1712. PMID 17379808. doi:10.1126/science.1138140.
- ↑ Marraffini LA, Sontheimer EJ. (2008). «CRISPR interference limits horizontal gene transfer in staphylococci by targeting DNA.». Science 322 (5909): 1843-5. PMID 19095942.
- ↑ Mali P, Esvelt KM, Church GM (2013). «Cas9 as a versatile tool for engineering biology». Nature methods 10 (10957-63). PMID 24076990.
- ↑ Kevin M Esvelt, Andrea L Smidler, Flaminia Catteruccia, George M Church (2014). «Concerning RNA-guided gene drives for the alteration of wild populations». eLife. doi:10.7554/eLife.03401.