
Back Orbital atomico AN مدار ذري Arabic Orbital atómicu AST Atom orbitalı Azerbaijani Атамная арбіталь Byelorussian Атомна орбитала Bulgarian পারমাণবিক কক্ষক Bengali/Bangla Atomska orbitala BS Orbital atòmic Catalan Atomový orbital Czech

In atoomteorie en kwantummeganika is 'n atoomorbitaal (of soms atoombaan of atoomwentelbaan) 'n wiskundige funksie wat die ligging en golfagtige gedrag van 'n elektron in 'n atoom beskryf.[1] Hierdie funksie kan gebruik word om die waarskynlikheid te bereken om enige elektron van 'n atoom in enige spesifieke streek rondom die atoomkern te vind. Die term atoomorbitaal kan ook verwys na die fisiese gebied of ruimte waar die elektron bereken kan word om te wees, soos voorspel deur die spesifieke wiskundige vorm van die orbitaal.[2]
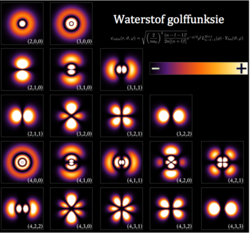
Elke wentelbaan in 'n atoom word gekenmerk deur 'n stel waardes van drie van die kwantumgetalle, naamlik elektronenergie (n), hoekmomentum (ℓ) en die magnetiese kwantumnommer (m). Elke orbitaal kan deur 'n maksimum van twee elektrone beset word, elk met sy eie spin-kwantumgetal (s). Die orbitale het eenvoudige name, s-orbitaal, p-orbitaal, d-orbitaal en f-orbitaal. Die name verwys na die hoekmomentum kwantumgetal, onderskeidelik ℓ = 0, 1, 2 en 3. Hierdie name, tesame met die waarde van n, word gebruik om die elektronkonfigurasies van atome te beskryf. Dit is afgelei van die vroeë beskrywing van sekere reekse van alkalimetaal-spektroskopiese lyne as skerp, prinsipieel, diffus en fundamenteel. Orbitale vir ℓ > 3 gaan alfabeties voort maar laat j weg (g, h, i , k , ... )[3][4][5] omdat sommige tale nie die letters " i " en "j" onderskei nie.[6]
Atoomorbitale is die basiese boustene van die atoombaanmodel (ook bekend as die elektronwolk- of golfmeganika-model), 'n moderne raamwerk om die submikroskopiese gedrag van elektrone in materie te visualiseer. In hierdie model kan die elektronwolk van 'n multi-elektronatoom by benadering gesien word as opgebou in 'n elektronkonfigurasie wat 'n produk is van eenvoudiger "waterstofagtige" atoomorbitale. Die herhalende periodisiteit van die blokke van 2, 6, 10 en 14 elemente binne gedeeltes van die periodieke tabel is natuurlik die gevolg van die totale aantal elektrone wat gevind word in 'n volledige stel van s, p, d en f atoomorbitale. Die orbitale behalwe s, dws. p, d, f, g, ens., kan verder opgebreek word in "suborbitale" wat tot 2 elektrone bevat. Die suborbitale word ook "sub-doppe" of "subskulpies" genoem.
Vir hoër waardes van die kwantumgetal n, veral wanneer die betrokke atoom 'n positiewe lading dra, word die energieë van sekere sub-orbitale baie dieselfde, en dus word die volgorder van bevolking van die elektrone in die orbitale deur gebruik van die Aufbau-beginsel ietwat willekeurig. Byvoorbeeld, die elektronkonfigurasie van Cr is [ Ar ]4s13d5 maar Cr2+ is [ Ar ]3d4. In die atoomfisika stem die atoomspektrale lyne ooreen met oorgange (kwantumspronge) tussen kwantumtoestande van 'n atoom. Hierdie toestande word gemerk deur 'n stel kwantumgetalle wat in die term simbool saamgevat word en gewoonlik geassosieer word met bepaalde elektronkonfigurasies, dws deur besettingskemas van atoomorbitale (byvoorbeeld 1s22s22p6 vir die grondtoestand van neon. Die grondtoestand het die simbool: 1S0).
- ↑ Verwysingfout: Invalid
<ref>tag; no text was provided for refs namedMilton2005 - ↑ Verwysingfout: Invalid
<ref>tag; no text was provided for refs namedDaintith2004 - ↑ Verwysingfout: Invalid
<ref>tag; no text was provided for refs namedGriffiths1995 - ↑ Verwysingfout: Invalid
<ref>tag; no text was provided for refs namedLevine2000 - ↑ Verwysingfout: Invalid
<ref>tag; no text was provided for refs namedLaidler1982 - ↑ Verwysingfout: Invalid
<ref>tag; no text was provided for refs namedAtkins2009