 Etanol
Etanol
 |
 |
| Substància química | tipus d'entitat química  |
|---|
| Massa molecular | 46,042 Da  |
|---|
| Trobat en el tàxon | ésser humà, Pomera comuna, Zingiber mioga, Coffea arabica, Rosa gàl·lica, Rosa damascena, Astragalus membranaceus, dacsa, figuera de moro, Parthenium tomentosum, Parthenium fruticosum, Parthenium schottii, Parthenium incanum, Guaiule, Parthenium confertum, Parthenium hysterophorus, Cinnamomum sieboldii, Micromeria myrtifolia, Guaiaber, Micromeria biflora, Plumeria rubra, Freesia hybrida, sindriera, Nepeta racemosa, Sideritis dichotoma, Clinopodium congestum, Origanum minutiflorum, Thymus longicaulis, Aster scaber, Geum heterocarpum, mango comú, Vaccinium ashei, tòfona negra, melonera, Callyspongia, Citrus grandis, llimona indonèsia, mandariner, Montipora, Petrosia durissima, espinac de Ceilan, pastanaga, Mycoacia uda, Spondias mombin, Vaccinium angustifolium, escheríchia coli, cebera, Pomera, Feijoa sellowiana, Salvia dorystaechas, Astragalus mongholicus, Corynocarpus laevigatus, matsutake, Cannabis sativa, Rosmarinus officinalis, Aranja, api, llúpol, Papaier, Garcinia dulcis, Capsicum annuum, Thymus sibthorpii, Magnolia obovata, Parkia speciosa, Aranja grossa, Citrus × deliciosa, Vaccinium virgatum, nabiu blau, feijoa sellowiana, Astragalus trimestris, Lucensosergia lucens, Sinorhizobium meliloti, maracujà i Fragaria 
|
|---|
| Rol | agent antiinfecciós local i depressor  |
|---|
|
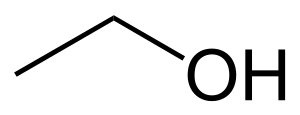
| Fórmula química | C₂H₆O  |
|---|
 |
| SMILES canònic | |
|---|
| Identificador InChI | Model 3D  |
|---|
|
| Densitat | 790 kg/m³ (a 20 °C, líquid)  |
|---|
| Velocitat del so | 1.162 m/s (20 °C, líquid)  |
|---|
| Índex de refracció | 1,3611  |
|---|
| PKa | 16  |
|---|
| Moment dipolar elèctric | 1,69 D  |
|---|
| Punt de fusió | −114 °C
−114 °C
−114,1 °C  |
|---|
| Punt d'ebullició | 78 °C (a 760 Torr)
79 °C (a 1 atm)
78,29 °C (a 101,325 kPa)  |
|---|
| Entropia molar estàndard | 160,7 J/(mol K) i 281,6 J/(mol K)  |
|---|
| Moment dipolar elèctric | 1,69 D  |
|---|
| Entalpia estàndard de formació | −277,6 kJ/mol i −234,8 kJ/mol  |
|---|
| Entalpia de combustió | −1.367 kJ/mol  |
|---|
| Pressió de vapor | 44 mmHg (a 20 °C)
58 hPa (a 20 °C)  |
|---|
| Capacitat calorífica | 13,444 J/(mol K)  |
|---|
|
| Sistema cristal·lí | sistema monoclínic  |
|---|
| Grup d'espai | grup espacial Pn  |
|---|
| Grup puntual | monoclinic-domatic (en)   |
|---|
|
| Límit inferior d'explosivitat | 3,3 vol%  |
|---|
| Límit superior d'explosivitat | 19 vol%  |
|---|
| Temperatura d'autoignició | 363 °C  |
|---|
| Límit d'exposició mitjana ponderada en el temps | 1.900 mg/m³ (10 h, Estats Units d'Amèrica)  |
|---|
| Punt d'inflamabilitat | 55 °F
12 °C  |
|---|
| IDLH | 6.237 mg/m³  |
|---|
NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response ()
Regulació europea de productes químics (GHS02: inflamable, GHS07: signe d'exclamació)  |
| Identificador Kemler | 33  |
|---|
| Classe de perill ONU | 3  |
|---|
| Grup d'embalatge ONU | II  |
|---|
|
Higroscopicitat i líquid inflamable de la classe IB  |
L'alcohol etílic, etanol o esperit de vi és un alcohol, de fórmula CH₃CH₂OH, que s'ha utilitzat habitualment en moltes cultures. Hi ha una gran varietat de begudes alcohòliques, que s'obtenen habitualment per fermentació de productes vegetals. Algunes de les més esteses són el vi i la cervesa.
És un líquid incolor i inflamable amb un punt d'ebullició de 78 °C. Es barreja amb aigua en qualsevol proporció i dona una barreja azeotròpica amb un contingut d'aproximadament el 96% d'etanol.
La fermentació del sucre en etanol fou una de les primeres reaccions orgàniques emprades per la humanitat. Els efectes intoxicants del consum d'etanol han estat coneguts des de fa mil·lennis. Avui en dia també es produeix etanol per un ús industrial a partir de subproductes de la refinació del petroli.[1]
L'etanol té un ús estès com a dissolvent de substàncies per a contacte o consum humà, incloent-hi perfums, aromatitzants, colorants i medicaments. En la química és un dissolvent essencial i també una matèria primera per la síntesi d'altres productes. Té una llarga història com a combustible per fer calor i llum, així com a combustible per motors de combustió interna.
Des de l'antiguitat s'obtenia l'etanol per fermentació anaeròbica d'una dissolució amb contingut en sucres, amb llevat i posterior destil·lació. En el transcurs de la destil·lació cal rebutjar la primera fracció que conté principalment metanol, que es forma en processos secundaris. Encara avui, aquest és l'únic mètode admès per a obtenir etanol per al consum humà. No obstant això, per a usos industrials el mètode d'obtenció preferit és per hidratació de l'etilè (H₂C=CH₂)
Per a obtenir etanol lliure d'aigua es poden utilitzar dessecants com el magnesi que reacciona amb l'aigua formant hidrogen i òxid de magnesi, encara que és preferible aplicar la destil·lació azeotròpica en una barreja amb benzè o ciclohexà. D'aquestes barreges es destil·la a temperatures més baixes l'azeotrop, format pel dissolvent auxiliar amb l'aigua, mentre que l'etanol es queda retingut.
- ↑ Myers, Richard L.; Myers, Rusty L.. The 100 most important chemical compounds: a reference guide. Westport (Connecticut): Greenwood Press, 2007, p. 122. ISBN 0313337586.



