
Back Swawel Afrikaans ድኝ Amharic Ixufre AN गन्धक ANP كبريت Arabic كبريت ARY كبريت ARZ Azufre AST ЧӀабатӀ AV सल्फर AWA
| Aquest article tracta sobre l'element químic. Si cerqueu el mineral natiu, vegeu «sofre natiu». |
| Sofre | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
16S
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||||||||||||||
Microcristalls sinteritzats de color groc llimona  Línies espectrals del sofre | |||||||||||||||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Sofre, S, 16 | ||||||||||||||||||||||||||||||||||||
| Categoria d'elements | No metalls | ||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 16, 3, p | ||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 32,065(5) | ||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Ne] 3s2 3p4 2, 8, 6 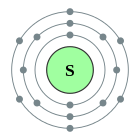
| ||||||||||||||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
(alfa) 2,07 g·cm−3 | ||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
(beta) 1,96 g·cm−3 | ||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
(gamma) 1,92 g·cm−3 | ||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
1,819 g·cm−3 | ||||||||||||||||||||||||||||||||||||
| Punt de fusió | 388,36 K, 115,21 °C | ||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 717,8 K, 444,6 °C | ||||||||||||||||||||||||||||||||||||
| Punt crític | 1.314 K, 20,7 MPa | ||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | (mono) 1,727 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | (mono) 45 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 22,75 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||
| Pressió de vapor | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 6, 5, 4, 3, 2, 1, -1, -2 (òxid àcid fort) | ||||||||||||||||||||||||||||||||||||
| Electronegativitat | 2,58 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||
| Energies d'ionització (més) |
1a: 999,6 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||
| 2a: 2.252 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||
| 3a: 3.357 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||
| Radi covalent | 105±3 pm | ||||||||||||||||||||||||||||||||||||
| Radi de Van der Waals | 180 pm | ||||||||||||||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Ortoròmbica 
| ||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Diamagnètic[1] | ||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) (amorf) 2×1015 Ω·m | ||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | (amorf) 0,205 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 7,7 GPa | ||||||||||||||||||||||||||||||||||||
| Duresa de Mohs | 2,0 | ||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7704-34-9 | ||||||||||||||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del sofre | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
El sofre és un element químic de nombre atòmic 16 i símbol S, i també és un mineral. És un no-metall abundant i insípid de color groc[2] i fa una olor característica, similar a la dels ous podrits.[3] El sofre es troba principalment en sulfurs (S2-) i sulfats (SO₄2-), i també en forma nativa (especialment en regions volcàniques). És un element químic essencial per a tots els organismes que es troba en dos dels aminoàcids que formen les proteïnes, la metionina i la cisteïna, i en coenzim A, molècula clau del metabolisme de tots els éssers vius. S'usa principalment com a fertilitzant però també en la fabricació de pólvora, laxants, llumins i insecticides.
Aquest element és generat en estels massius en què predominen temperatures que provoquen la fusió entre un nucli de silici i un altre d'heli en un procés denominat nucleosíntesi de supernoves.[4]
- ↑ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics. CRC press, 2000. ISBN 0849304814.
- ↑ «azufre». A: Alfabético temática Invicta (en castellà). Colòmbia: Editorial Norma, 2001, p. 932. ISBN 978-958-04-5870-8. Arxivat 2024-08-06 a Wayback Machine.
- ↑ «Sulphur - S» (en anglès). Lenntech. Arxivat de l'original el 24 de novembre 2016. [Consulta: 7 desembre 2016].
- ↑
 Fusión Estelar (subtiltulado en castellano) a YouTube
Fusión Estelar (subtiltulado en castellano) a YouTube