
Back Koolstof Afrikaans Kohlenstoff ALS ካርቦን Amharic Carbonio AN कार्बन ANP كربون Arabic كاربون ARY كاربون ARZ কাৰ্বন Assamese Carbonu AST
| Carbon
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
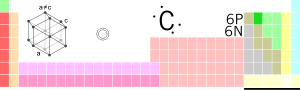
| Symbol | C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rhif | 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dwysedd | 2267 kg m-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Elfen gemegol yn y tabl cyfnodol yw carbon (o'r Lladin carbo "glo"): , gyda'r symbol C a'r rhif atomig 6. Fela aelod o Elfen Grŵp 14, mae'n anfetel gyda sawl alotrop yn bodoli o dan dymheredd a gwasgedd safonol, gan gynnwys: graffit (solid du anhydawdd), diemwnt (solid caled tryloyw) a ffwlerenau (solidau du hydawdd). Graffit yw'r ffurf sefydlog, gyda diemwnt yn ffurf cyfarwydd arall sy'n dangos sefydlogrwydd cinetig, ond mae'n newid i raffit o dan gwres uchel iawn.[1] Mae ganddo briodweddau amrywiol iawn: mae diamwnd yn dryloyw a graffid yn ddu fel glo. Diamwnd yw'r deunyd caletaf sy'n bodoli ar wyneb y ddaear ac ar y llaw arall, mae graffid yn feddal - fel 'plwm' pensil yn gadael ei ôl ar bapur; ystyr gwreiddiol "graffid" ydy "γράφω" neu "ysgrifen". Ar y naill law: prin fod diamwnd yn dargludo trydan, ond mae gan graffin a charbon nanotiwb,ar y llaw arall, y gallu i ddargludo gwres yn well nag unrhyw ddeunydd arall. Un elfen, ond y ddau begwn eithaf, mewn sawl ffordd.
Ceir tri isotop naturiol, gyda 12C a 13C yn sefydlog a 14C yn ymbelydrol efo hanner oes o tua 5,730 years.[2] Mae'n un o'r cyfansoddion prin hynny y gwyddom amdano ers cyn cof.[3]
Mae'r ffwlerenau yn alotropau anarferol sydd newydd cael eu darganfod dros yr ugain mlynedd diwethaf, a'r un mwyaf cyfarwydd yr C60 sy'n bodoli fel sffêr o atomau o garbon yn debyg i'r patrwm ar wyneb pêl pêl-droed.
Mae pob alotrop o garbon yn solid o dan amgylchiadau arferol, gyda graffid y mwyaf sefydlog. Mae'n wrthiannol i gemegau, ac angen tymeredd uchel iawn i adweithio gydag ocsigen. Cyflwr ocsidiad mwyaf cyffredin carbon mewn cyfansoddion anorganig ydy +4, er y ceir +2 mewn carbon monocsid
Ffynhonnell mwyaf carbonau anorganig ydy calchfaen, dolomidau a charbon deuocsid, ond ceir cyflenwad mawr ohono mewn defnyddiau organig: glo, mawn, olew ayb. Mae carbon yn ffurfio llawer iawn o gyfansoddion - mwy na'r un elfen arall - gyda dros deg miliwn wedi'u disgrifio'n wyddonol, hyd yma (2014),[4] rhan fechan iawn o'r cyfansoddion posib, theoretig.
- ↑ "World of Carbon – Interactive Nano-visulisation in Science & Engineering Education (IN-VSEE)". Archifwyd o'r gwreiddiol ar 2008-10-05. Cyrchwyd 2008-10-09.
- ↑ "Carbon – Naturally occurring isotopes". WebElements Periodic Table. Cyrchwyd 2008-10-09.
- ↑ "History of Carbon". Archifwyd o'r gwreiddiol ar 2012-11-01. Cyrchwyd 2013-01-10.
- ↑ Chemistry Operations (December 15, 2003). "Carbon". Los Alamos National Laboratory. Archifwyd o'r gwreiddiol ar 2008-09-13. Cyrchwyd 2008-10-09.
