
Back Etanol Afrikaans Ethanol ALS Etanol AN إيثانول Arabic ইথান'ল Assamese Etanol AST दारु AWA Etanol Azerbaijani اتانول AZB Этанол Bashkir
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
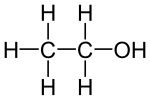
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Ethanol | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C2H6O | |||||||||||||||||||||
| Kurzbeschreibung |
klare, farblose, würzig riechende und brennend schmeckende, leichtentzündliche, hygroskopische[2] Flüssigkeit[2][3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 46,07 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
78,32 °C[2] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert |
16[5] | |||||||||||||||||||||
| Löslichkeit |
beliebig mit Wasser, Diethylether, Chloroform, Benzin und Benzol mischbar[2] | |||||||||||||||||||||
| Brechungsindex |
1,3638[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Das Ethanol (IUPAC) oder der Ethylalkohol,[15] auch Äthanol[16] oder Äthylalkohol, gemeinsprachlich auch (gewöhnlicher) Alkohol genannt,[17] ist ein aliphatischer, einwertiger, primärer Alkohol mit der Summenformel C2H6O.
Die reine Substanz ist eine bei Raumtemperatur farblose, leicht entzündliche Flüssigkeit mit einem brennenden Geschmack und einem charakteristischen, würzigen (süßlichen) Geruch. Die als Lebergift eingestufte Droge wird bei der Herstellung von Genussmitteln und alkoholischen Getränken wie Wein, Bier und Spirituosen aus kohlenhydrathaltigem Material durch eine von Hefen ausgelöste Gärung in großem Maßstab produziert.
Die Vergärung von Zucker zu Ethanol ist eine der ältesten bekannten biochemischen Reaktionen. Seit dem 19. Jahrhundert wird Ethanol für industrielle Zwecke aus Ethen hergestellt. Ethanol hat eine weite Verbreitung als Lösungsmittel für Stoffe, die für medizinische oder kosmetische Zwecke eingesetzt werden, wie Duftstoffe, Aromen, Farbstoffe oder Medikamente sowie als Desinfektionsmittel. Die chemische Industrie verwendet es sowohl als Lösungsmittel als auch als Ausgangsstoff für die Synthese weiterer Produkte wie Carbonsäureethylester.
Ethanol wird energetisch als Biokraftstoff, etwa als sogenanntes Bioethanol verwendet. Beispielsweise enthält der Ethanol-Kraftstoff E85 einen Ethanolanteil von 85 Volumenprozent.
- ↑ Eintrag zu ALCOHOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2019.
- ↑ a b c d e f g Eintrag zu Ethanol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. März 2015.
- ↑ Gerhard Eisenbrand (Hrsg.), Peter Schreier (Hrsg.): RÖMPP Lexikon Lebensmittelchemie. 2. Auflage. Thieme Verlag, Stuttgart 2006, S. 322.
- ↑ a b c d e f g Eintrag zu Ethanol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- ↑ Eintrag zu Ethanol in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar • Bitte Vorlage:ChemID durch die evtl. dort oder dort angegebene Primärquelle(n) ersetzen)
- ↑ Eintrag zu Ethanol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 64-17-5 bzw. Ethanol), abgerufen am 13. September 2019.
- ↑ G. Stuart Wiberg, H. Locksley Trenholm, Blake B. Coldwell: Increased ethanol toxicity in old rats: Changes in LD50, in vivo and in vitro metabolism, and liver alcohol dehydrogenase activity. In: Toxicology and Applied Pharmacology. Vol. 16, 1970, S. 718–727, doi:10.1016/0041-008X(70)90077-3.
- ↑ Gigiena i Sanitariya. For English translation, see HYSAAV, 1967, Vol. 32(3), S. 31.
- ↑ Raw Material Data Handbook. Vol. 1: Organic Solvents, 1974, S. 44.
- ↑ Matti Välimäki, Matti Härkönen, Reino Ylikahri: Acute Effects of Alcohol on Female Sex Hormones. In: Alcoholism: Clinical and Experimental Research. Vol. 7, 1983, S. 289–293, doi:10.1111/j.1530-0277.1983.tb05462.x.
- ↑ S. J. Baker, G. J. Chrzan, C. N. Park, J. H. Saunders: Behavioral effects of 0 and 0.05 % blood alcohol in male volunteers. In: Neurobehavioral Toxicology and Teratology. Vol. 8, 1986, S. 77–81, PMID 3703098.
- ↑ M. Yamagishi, T. Iwasaki: Acute alcohol intoxication in a two-month-old baby. In: Journal of UOEH. Vol. 9, 1987, S. 53–59, PMID 3576010.
- ↑ a b W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-18.
- ↑ Chemisch-fachsprachliche Ausdrücke, vgl. Eintrag Ethanol bzw. Ethylalkohol in duden-online; abgerufen am 13. Mai 2018.
- ↑ Äthanol. duden-online; abgerufen am 14. Mai 2018.
- ↑ Äthylalkohol. duden-online; abgerufen am 14. Mai 2018.

