
Back ليزوزيم Arabic লাইসোজাইম Bengali/Bangla Lizozim BS Lisozim Catalan Lysozym Czech LYZ Welsh Lysozym Danish Λυσοζύμη Greek Lysozyme English Lisozima Spanish
| Lysozym C (Gallus gallus) | ||
|---|---|---|
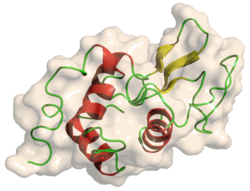
| ||
| Struktur von Lysozym nach PDB 132L | ||
|
Vorhandene Strukturdaten: siehe UniProt | ||
| Masse/Länge Primärstruktur | 14,3 kDa / 129 Aminosäuren | |
| Sekundär- bis Quartärstruktur | (β)αα(β)βββαα, Lysozym-ähnlich | |
| Bezeichner | ||
| Gen-Name(n) | LYZ | |
| Externe IDs |
| |
| Arzneistoffangaben | ||
| ATC-Code | D06BB07 J05AX02 | |
| Enzymklassifikation | ||
| EC, Kategorie | 3.2.1.17, Glycosidase | |
| Reaktionsart | Hydrolyse β-1,4-glycosidischer Bindungen zwischen NAM und NAG | |
| Substrat | Peptidoglycan | |
| Produkte | Spaltprodukte | |
| Vorkommen | ||
| Homologie-Familie | Lactalbumin/Lysozym | |
| Übergeordnetes Taxon | Schleimpilze, Schwämme, Bilateria, Pilze, Bakterien, Phagen | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 4069 | 17105 |
| Ensembl | ENSG00000090382 | ENSMUSG00000069516 |
| UniProt | P61626 | P08905 |
| Refseq (mRNA) | NM_000239 | NM_017372 |
| Refseq (Protein) | NP_000230 | NP_059068 |
| Genlocus | Chr 12: 69.35 – 69.35 Mb | Chr 10: 117.28 – 117.28 Mb |
| PubMed-Suche | 4069 | 17105
|
Lysozym (auch Muramidase) ist ein Enzym, das β-1,4-Glycosidische Bindungen zwischen N-Acetylmuraminsäure- (NAM) und N-Acetylglucosaminresten (NAG) in Peptidoglycanen, aus Zuckerderivaten und Peptiden aufgebauten Makromolekülen, hydrolysiert. Lysozyme kommen als Teil des angeborenen Immunsystems bei Tieren vor und können außerdem in Pflanzen, Pilzen, Bakterien und bei Bakteriophagen gefunden werden. Beim Menschen führen Mutationen im LYZ-Gen zu einer seltenen erblichen Form der Amyloidose.[1]
- ↑ Pierre Jollès, Jacqueline Jollès: What’s new in lysozyme research? Always a model system, today as yesterday. In: Molecular and Cellular Biochemistry. Band 63, Nr. 2, September 1984, S. 165–189, doi:10.1007/BF00285225, PMID 6387440.