| Dicloro | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Dicloro | ||
| General | ||
| Otros nombres | Dicloro | |
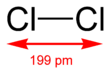
| Fórmula semidesarrollada | Cl-Cl | |
| Fórmula estructural |
 | |
| Fórmula molecular | Cl2 | |
| Identificadores | ||
| Número CAS | 7782-50-5[1] | |
| Número RTECS | FO2100000 | |
| ChEBI | 29310 | |
| DrugBank | DB11109 | |
| PubChem | 24526 | |
| UNII | 4R7X1O2820 | |
| Propiedades físicas | ||
| Apariencia | Gas amarillo verdoso | |
| Masa molar | 69,93770536 g/mol | |
| Punto de fusión | 172 K (−101 °C) | |
| Punto de ebullición | 239 K (−34 °C) | |
| Temperatura crítica | 416 K (143 °C) | |
| Presión crítica | 78,87 atm | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El dicloro (según la IUPAC[2]) o cloro diatómico (también llamado cloro molecular, o antiguamente gas cloro o simplemente cloro) es una molécula diatómica homonuclear formada por dos átomos de cloro. En condiciones normales de presión y temperatura es un gas amarillo-verdoso, unas 2,5 veces más pesado que el aire, de olor desagradable y venenoso. El dicloro gaseoso es muy tóxico (neumotóxico) y se usó como gas de guerra en la Primera Guerra Mundial (la bertolita), a partir de la cual comenzaron a usarse armas químicas.
- ↑ Número CAS
- ↑ International Union of Pure and Applied; Nomenclature of inorganic chemistry - IUPAC recommendations 2005; 2005; 0-85404-438-8; [1]
