
Back Distillasie Afrikaans تقطير Arabic تقطير ARY تقطير ARZ Destilación AST Перагонка Byelorussian Перагонка BE-X-OLD Дестилация Bulgarian পাতন Bengali/Bangla Destilacija BS
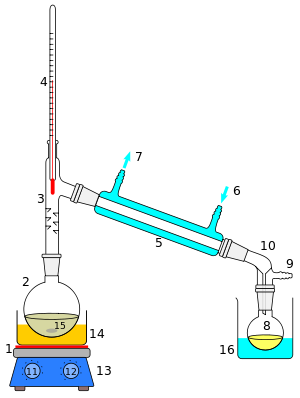
1 – soojusallikas,
2 – destillatsiooni kolb,
3 – destillatsiooni pealis (deflegmaatoriga),
4 – termomeeter,
5 – Liebigi jahuti (kondensaator),
6 – jahutusvee sisend,
7 – jahutusvee väljund,
8 – destillaadi vastuvõtja,
9 – ühendus vaakumpumbaga,
10 – allonž (piip),
11-13 – küttekeha koos temperatuuri ja segamiskiiruse regulaatoritega,
14 – õli- (või liiva- või vee-)vann,
15 – magnetsegaja (või muud inertsed lisandid ühtlase keemise tagamiseks),
16 – jahutusnõu
Destilleerimiseks ehk destillatsiooniks nimetatakse vedeliku aurustamist keetmisel ja sellele järgnevat kondenseerimist vastuvõtjasse. See on vedelate segude korral kasutatav lahutamise (puhastamise) meetod, mis põhineb keeva segu komponentide lenduvuse erinevusel. Destillatsioon on füüsikaline lahutusmeetod, mitte keemiline reaktsioon.
Seadet, mille abil vedelikke eraldatakse lahusest, nimetatakse destilleerimisseadmeks ehk destillaatoriks.
Selle protsessi puhul lahutatavat segu keedetakse. Aurufaas on kergemini lenduvate komponentide poolest rikkam kui vedel faas, tekkivad aurud kondenseeritakse ja kogutakse destillaadina, mille koostis sarnaneb aurufaasi omaga.
Eri ainetel on erinev keemistemperatuur. Aine hakkab keema temperatuuril, mille juures tema aururõhk saab võrdseks välisrõhuga. See kehtib ka ainete segu korral. Komponendi aururõhk sõltub tema moolkontsentratsioonist ainete segus. Raoulti ja Daltoni seadustest tuleneb valem:
- PA = PA0 • X,
kus X on komponendi moolkontsentratsioon vedelas faasis; PA0 on puhta komponendi A aururõhk; PA komponendi aururõhk segus. Reaalsetes süsteemides kehtib see valem ligikaudu.
Keemialaborites ja keemiatööstustes on destillatsioon väga palju kasutatav protsess ning välja on töötatud erinevaid võimalusi pakkuvad meetodid. Destilleerida võib nii pideva (tavaliselt tööstuses) kui ka tsüklilise (tavaliselt laboris) protsessina.