Back Koolstofdioksied Afrikaans Kohlenstoffdioxid ALS ካርቦን ክልቶኦክሳይድ Amharic Dioxido de carbonio AN ثنائي أكسيد الكربون Arabic কাৰ্বন ডাই অক্সাইড Assamese Dióxidu de carbonu AST Karbon qazı Azerbaijani کربون دیاوکسید AZB Onglėis dvėdegėnis BAT-SMG
| Dioxyde de carbone | |
  Structure du dioxyde de carbone. |
|
| Identification | |
|---|---|
| Nom UICPA | Dioxyde de carbone |
| Synonymes |
Gaz carbonique, anhydride carbonique |
| No CAS | |
| No ECHA | 100.004.271 |
| No CE | 204-696-9 |
| Code ATC | V03 |
| PubChem | 280 |
| ChEBI | 16526 |
| No E | E290 |
| SMILES | |
| InChI | |
| Apparence | Gaz comprimé liquéfié, incolore et inodore[1] |
| Propriétés chimiques | |
| Formule | CO2 [Isomères] |
| Masse molaire[2] | 44,009 5 ± 0,001 4 g/mol C 27,29 %, O 72,71 %, |
| Propriétés physiques | |
| T° fusion | −78,48 °C (sublimation à 760 mmHg)[3] |
| T° ébullition | −56,6 °C (5,12 atm)[3] |
| Solubilité | dans l'eau à 20 °C : 88 ml/100 ml[1] sous 1 bar de CO2, soit 1,69 g/kg d'eau (3,35 g à 0 °C, 0,973 g à 40 °C et 0,576 g à 60 °C)[4] |
| Masse volumique | 1,87 kg m−3 (gaz à 15 °C 1,013 bar) plus dense que l'air |
| Pression de vapeur saturante | 5 720 kPa (20 °C)[1] 569,1 mmHg (−82 °C) ; |
| Viscosité dynamique | 0,07 mPa s à −78 °C |
| Point critique | 31,3 °C ; 72,9 atm et 0,464 g cm−3[3] |
| Point triple | −56,6 °C à 5,11 atm[3] |
| Conductivité thermique | 3,840 × 10−5 cal cm−1 s−1 K−1 à 20 °C |
| Vitesse du son | 259 m s−1 (0 °C,1 atm)[6] |
| Thermochimie | |
| ΔfH0gaz | −393,52 kJ mol−1[7] |
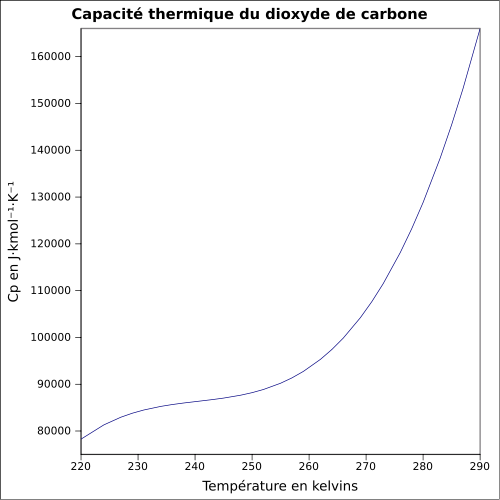
| Cp | |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 13,773 ± 0,002 eV (gaz)[9] |
| Cristallographie | |
| Classe cristalline ou groupe d’espace | P42/mnm |
| Paramètres de maille | a = 3,535 Å b = 3,535 Å |
| Volume | 51,73 Å3[10] |
| Propriétés optiques | |
| Indice de réfraction | 1,000 45 (1 atm) |
| Précautions | |
| SGH[12] | |
| H280, P403 et P410 |
|
| SIMDUT[13] | |
 A, |
|
| Transport | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le dioxyde de carbone, aussi appelé gaz carbonique ou anhydride carbonique, est un composé inorganique dont la formule chimique est CO2, la molécule ayant une structure linéaire de la forme O=C=O. Il se présente, sous les conditions normales de température et de pression, comme un gaz incolore, inodore, à la saveur piquante.
Le CO2 est utilisé par l'anabolisme des végétaux pour produire de la biomasse à travers la photosynthèse, processus qui consiste à réduire le dioxyde de carbone par l'eau, grâce à l'énergie lumineuse reçue du Soleil et captée par la chlorophylle, en libérant de l'oxygène pour produire des oses, et en premier lieu du glucose par le cycle de Calvin. Le CO2 est libéré, à travers le cycle de Krebs, par le catabolisme des plantes, des animaux, des fungi (mycètes, ou champignons) et des micro-organismes. Ce catabolisme consiste notamment à oxyder les lipides et les glucides en eau et en dioxyde de carbone grâce à l'oxygène de l'air pour produire de l'énergie et du pouvoir réducteur, sous forme respectivement d'ATP et de NADH + H+. Le CO2 est par conséquent un élément fondamental du cycle du carbone sur notre planète. Il est également produit par la combustion des énergies fossiles telles que le charbon, le gaz naturel et le pétrole, ainsi que par celle de toutes les matières organiques en général. C'est un sous-produit indésirable dans les processus industriels à grande échelle.
Des quantités significatives de CO2 sont par ailleurs rejetées par les volcans et autres phénomènes géothermiques tels que les geysers.
En décembre 2023, l'atmosphère terrestre comportait 421 ppmv (parties par million en volume) de CO2, soit 0,0421 %. Cette teneur était de 283 ppmv en 1839 d'après des carottes de glace prélevées dans l'Antarctique, soit une augmentation globale d'environ 49 % en 184 ans.
Le CO2 est un gaz à effet de serre majeur, transparent en lumière visible mais absorbant dans le domaine infrarouge, de sorte qu'il tend à bloquer la réémission vers l'espace de l'énergie thermique reçue au sol sous l'effet du rayonnement solaire. Il est responsable d'environ 26 % de l'effet de serre à l'œuvre dans l'atmosphère terrestre (la vapeur d'eau en assurant 60 %) ; l'augmentation de sa concentration est responsable de l'essentiel du changement climatique constaté à l'échelle de notre planète depuis les dernières décennies du XXe siècle. Par ailleurs, l'acidification des océans résultant de la dissolution du dioxyde de carbone atmosphérique pourrait compromettre la survie de nombreux organismes marins avant la fin du XXIe siècle.
- DIOXYDE DE CARBONE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Carbon dioxide », sur Hazardous Substances Data Bank (consulté le )
- Bernard M. et Busnot F. (1996), Usuel de chimie générale et minérale, Dunod, Paris, p. 229.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) W. M. Haynes, Handbook of Chemistry and Physics, CRC, 2010-2011, 91e éd., 2610 p. (ISBN 978-1-4398-2077-3), p. 14-40
- (en) Irvin Glassman et Richard A. Yetter, Combustion, Amsterdam/Boston, Elsevier, , 4e éd., 773 p. (ISBN 978-0-12-088573-2), p. 6
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1-3, Huston, Texas, Gulf Pub., (ISBN 0-88415-857-8, 978-0-88415-858-5 et 978-0-88415-859-2)
- (en) David R. Lide, Handbook of Chemistry and Physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- « Carbon Dioxide », sur www.reciprocalnet.org (consulté le )
- Entrée du numéro CAS « 124-38-9 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 6 décembre 2008 (JavaScript nécessaire)
- SIGMA-ALDRICH
- « Dioxyde de carbone » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009