
Back Stikstofmonoksied Afrikaans أحادي أكسيد النيتروجين Arabic نیتریک اوکسید AZB Азотен оксид Bulgarian নাইট্রিক অক্সাইড Bengali/Bangla Dušik-monoksid BS Monòxid de nitrogen Catalan Oxid dusnatý Czech Nitrogenmonoxid Danish Stickstoffmonoxid German
| Monoxyde d'azote | |
  Molécule de monoxyde d'azote. |
|
| Identification | |
|---|---|
| Nom UICPA | Monoxyde d'azote |
| No CAS | |
| No ECHA | 100.030.233 |
| No CE | 233-271-0 |
| Code ATC | R07 |
| PubChem | 145068 |
| SMILES | |
| InChI | |
| Apparence | gaz comprime incolore[1]. |
| Propriétés chimiques | |
| Formule | NO [Isomères] |
| Masse molaire[3] | 30,006 1 ± 0,000 5 g/mol N 46,68 %, O 53,32 %, |
| Moment dipolaire | 0,158 72 D[2] |
| Propriétés physiques | |
| T° fusion | −163,6 °C[1] |
| T° ébullition | −151,8 °C[1] |
| Solubilité | dans l'eau à 0 °C : 7,4 ml/100 ml[1] |
| Masse volumique | 1,3 kg l−1 (liquide)
|
| Pression de vapeur saturante | |
| Point critique | 65,8 bar, −93,35 °C[5] |
| Vitesse du son | 325 m s−1 (10 °C,1 atm)[6] |
| Thermochimie | |
| S0gaz, 1 bar | 211 J mol−1 K−1[réf. souhaitée] |
| ΔfH0gaz | 90,29 kJ·mol-1[7] |
| ΔfH0liquide | 87,7 kJ/mol[réf. souhaitée] |
| ΔvapH° | 13,83 kJ mol−1 (1 atm, −151,74 °C)[8] |
| Cp | |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 9,264 38 ± 0,000 05 eV (gaz)[9] |
| Précautions | |
| SGH | |
| H270, H314 et H330 |
|
| SIMDUT[10] | |
    A, C, D1A, E, |
|
| Directive 67/548/EEC | |
| Transport | |
| Inhalation | Dangereuse, peut conduire à la mort |
| Peau | Irritant |
| Yeux | Peut causer des irritations |
| Ingestion | Utilisé à des fins thérapeutiques, mais présente des effets indésirables et est dangereux en surdosage |
| Écotoxicologie | |
| Seuil de l’odorat | bas : 0,29 ppm haut : 0,97 ppm[11] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le monoxyde d'azote, oxyde azotique, oxyde nitrique ou NO est un composé chimique formé d'un atome d'oxygène et d'un atome d'azote. C'est un gaz dans les conditions normales de température et de pression. C'est un important neurotransmetteur chez les mammifères ; dissous, il franchit facilement les membranes biologiques et passe d'une cellule à l'autre, constituant un « messager paracrine idéal »[12].
Le monoxyde d'azote (NO) ne doit pas être confondu avec d'autres oxydes d'azote, tels le protoxyde d'azote N2O, que l'on appelle « gaz hilarant », et qui est un anesthésique général, ou le dioxyde d'azote NO2, gaz rouge-brun extrêmement irritant et nocif, qui se forme par oxydation rapide de NO par l'oxygène de l'air.
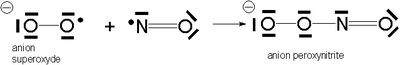
Sa grande réactivité (en phase soluble notamment) vis-à-vis des composés radicalaires comme l'oxygène moléculaire — qui est un biradical — ou l'anion superoxyde est due au fait qu'il est lui-même un composé radicalaire — son spin électronique total vaut 1/2. En milieu biologique, sa demi-vie est estimée entre une et cinq secondes[13], voire trente secondes[14]. Les peroxynitrites obtenus sont de puissants agents oxydants et nitrants[15]. Ceci explique des effets ubiquitaires encore mal compris, allant de la réponse immunitaire aux agressions microbiennes et des processus inflammatoires au choc septique et à la mort neuronale en phase d'ischémie. Il est aussi impliqué dans les mécanismes cellulaires de l'apprentissage mémoriel, ou encore dans le phénomène de l'érection.
- MONOXYDE D'AZOTE, Fiches internationales de sécurité chimique .
- (en) David R. Lide, Handbook of Chemistry and Physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- « Properties of Various Gases », sur flexwareinc.com (consulté le ).
- (en) W. M Haynes, Handbook of Chemistry and Physics, CRC, 2010-2011, 91e éd., 2610 p. (ISBN 978-1-4398-2077-3), p. 14-40.
- (en) Irvin Glassman et Richard A. Yetter, Combustion, Elsevier, , 4e éd., 773 p. (ISBN 978-0-12-088573-2), p. 6.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press, , 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0).
- (en) David R. Lide, Handbook of Chemistry and Physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205.
- « Monoxyde d'azote » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- « Nitric oxide », sur hazmap.nlm.nih.gov (consulté le ).
- Crépel, F. et Lemaire, G. (1995), Le monoxyde d'azote [PDF], Revue MS (médecine/sciences), 11:1639-42, 4 p.
- Gabbai, F. B., Garcia, G. E. et al., Role of nitric oxide in glomerular physiology and pathophysiology, Adv. Nephrol. Necker Hosp., 24, 3-18 (1995).
- R. A. Schroeder et P. C. Kuo, Nitric oxide: physiology and pharmacology, Anesth. Analg., 81, 1052-9 (1995).
- Enthalpie d'isomérisation de l'ion peroxynitrite en nitrate.
















