
Back Litiumoksied Afrikaans أكسيد الليثيوم Arabic لیتیوم اوکسید AZB Litij-oksid BS Òxid de liti Catalan Oxid lithný Czech Lithiumoxid German Οξείδιο του λιθίου Greek Lithium oxide English Óxido de litio Spanish
| Oxyde de lithium | |
| |
| Identification | |
|---|---|
| Synonymes |
lithine, oxyde de lithine |
| No CAS | |
| No ECHA | 100.031.823 |
| No CE | 235-019-5 |
| Apparence | poudre |
| Propriétés chimiques | |
| Formule | Li2O [Isomères] |
| Masse molaire[1] | 29,881 ± 0,004 g/mol Li 46,46 %, O 53,54 %, |
| Propriétés physiques | |
| T° fusion | 1 570 °C |
| Solubilité | Hydrolyse violente en LiOH |
| Masse volumique | 2 013 kg·m-3 |
| Cristallographie | |
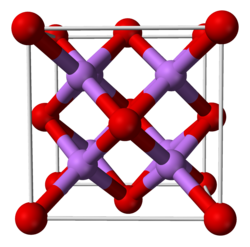
| Système cristallin | Cubique |
| Symbole de Pearson | [2] |
| Classe cristalline ou groupe d’espace | Fm3m (n°225) [2] |
| Strukturbericht | C1[2] |
| Structure type | CaF2 [2] |
| Précautions | |
| SIMDUT[3] | |
 E, |
|
| Directive 67/548/EEC | |
| Composés apparentés | |
| Autres cations | Oxyde de sodium Oxyde de potassium Oxyde de rubidium Oxyde de césium |
| Autres anions | Sulfure de lithium |
| Autres composés | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'oxyde de lithium est un composé chimique de formule Li2O. Il se forme avec de petites quantités d'hydroxyde de lithium LiOH lorsque le lithium métallique brûle dans l'air et se combine avec l'oxygène et l'eau atmosphériques :
- 4 Li + O2 → 2 Li2O
- 4 Li + 2 H2O + O2 → 4 LiOH
L'oxyde de lithium présente à l'état solide une structure cristalline de type antifluorine, c'est-à-dire une structure calquée sur celle du fluorure de calcium CaF2 mais où les cations et les anions y jouent le rôle opposé. À l'état gazeux fondamental, la molécule Li2O est linéaire, contrairement aux résultats prévus par la théorie VSEPR (d'après laquelle la molécule Li2O devrait avoir la même forme que la molécule d'H2O), ce qui est cohérent avec une géométrie gouvernée par les liaisons ioniques.
Li2O résulte de la décomposition thermique du peroxyde de lithium Li2O2 et attaque la silice à température élevée.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « The Fluorite (C1) Structure », sur cst-www.nrl.navy.mil (consulté le ).
- « Oxyde de lithium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009

