
Back Fosfaat Afrikaans فوسفات Arabic فوسفات ARZ Fosfatu AST Fosfat Azerbaijani فوسفات AZB Фасфаты Byelorussian Фосфат Bulgarian Fosfat BS Fosfat Catalan
| Phosphate | |
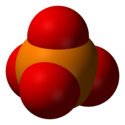 Structure tridimensionnelle d'un ion phosphate 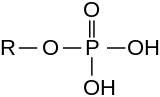 Structure d'un groupe phosphate lié à un radical R |
|
| Identification | |
|---|---|
| No CAS | |
| PubChem | |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | PO43− |
| Masse molaire[1] | 94,971 4 ± 0,001 2 g/mol O 67,39 %, P 32,61 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|


Un phosphate est un composé dérivé de l'acide phosphorique H3PO4 par perte ou substitution d'un ou plusieurs atomes d'hydrogène, par d'autres atomes ou groupes fonctionnels.
En chimie minérale, c'est un sel résultant de l'attaque d'une base par cet acide, ou l'anion faisant partie de ce sel. Les ions orthophosphates sont les formes chimiques les plus fréquentes du phosphate dans l’environnement (H2PO4−, HPO42−, PO43−), tous dérivés de l'acide phosphorique par perte d'un à trois atomes d'hydrogène. Ils sont utilisés dans certains engrais, lessives, comme inhibiteurs de corrosion ou additifs alimentaires (ils portent alors les numéros E338 à E343 si ce sont des orthophosphates, E450 à E455 si ce sont des polyphosphates). Présents en excès dans l'eau, ils sont source d'eutrophisation (voire de dystrophisation).
En chimie organique, un phosphate est un type de composé organophosphoré ; les groupes substituants des hydrogènes de l'acide phosphorique peuvent alors être des chaînes carbonées, on parle parfois de phosphate organique.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Le cycle biogéochimique et écologique du phosphore a été modifié par l'Homme qui l'a récemment massivement introduit sous forme d'engrais (eutrophisant) dans les agrosystèmes, et indirectement dans les écosystèmes (Atlas mondial des océans).