Back Plutonium Afrikaans Plutonium ALS ፕሉቶኒየም Amharic Plutonio AN प्लोटोनियम ANP بلوتونيوم Arabic پلوطونيوم ARY بلوتونيوم ARZ Plutoniu AST Plutonium Azerbaijani
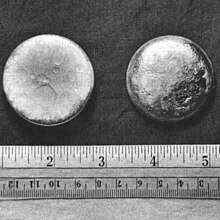
Le plutonium est l'élément chimique de symbole Pu et de numéro atomique 94. C'est un métal radioactif transuranien de la famille des actinides. Il se présente sous la forme d'un solide cristallisé dont les surfaces fraîches sont gris argenté mais se couvrent en quelques minutes, en présence d'humidité, d'une couche terne de couleur grise, tirant parfois sur le vert olive, constituée d'oxydes et d'hydrures ; l'accroissement de volume qui en résulte peut atteindre 70 % d'un bloc de plutonium pur, et la substance ainsi formée tend à se désagréger en une poudre pyrophorique.
Le plutonium a été produit et isolé pour la première fois le 14 décembre 1940 à l'université de Californie à Berkeley en bombardant de l'uranium 238 par du deutérium. Venant à la suite de l'uranium et du neptunium dans le tableau périodique, ce nouvel élément chimique a été nommé en référence à Pluton, qui vient à la suite des planètes Uranus et Neptune dans le Système solaire. C'est un élément synthétique, produit artificiellement par l'homme, mais on rapporte également l'observation de traces de plutonium naturel dans des minerais d'uranium. Il s'agit d'un métal lourd radiotoxique qui tend à s'accumuler dans les os et, dans une moindre mesure, dans le foie. On observe couramment quatre états d'oxydation du plutonium, de +3 à +6 (l'état +7 est rare), avec des colorations distinctes. La structure électronique du métal pur est déterminée par la bande 5f, qui présente la plus grande densité d'états au niveau de Fermi ; particulièrement étroite, la bande 5f tend à localiser les électrons qui s'y trouvent, de sorte que le plutonium pur à température ambiante est semblable aux matériaux à fermions lourds, avec une capacité thermique et une résistivité électrique élevées.
On connaît pas moins de six allotropes du plutonium à pression atmosphérique, et un septième au-delà de 60 MPa. Ils ont des propriétés bien tranchées et souvent inhabituelles pour un métal. Ainsi, le plutonium α, stable à température ambiante, est l'un des très rares métaux à cristalliser dans le système monoclinique ; ses propriétés physiques et structurelles relèvent davantage des minéraux que des métaux usuels, tandis que ses propriétés mécaniques rappellent celles de la fonte. Le plutonium δ, stable à température plus élevée ou avec une faible fraction molaire de gallium, cristallise en revanche dans une maille cubique à faces centrées, avec une masse volumique inférieure de près de 20 % à celle du plutonium α ; il est davantage métallique, avec des propriétés mécaniques semblables à l'aluminium, mais un coefficient de dilatation thermique négatif (il se contracte en chauffant). Le plutonium est également l'un des rares éléments chimiques dont le liquide est plus dense que le solide au point de fusion. L'existence de multiples allotropes aux énergies internes voisines rend la mise en forme du plutonium particulièrement délicate, au point qu'on utilise plutôt un alliage plutonium-gallium, qui stabilise la phase δ à température ambiante, ce qui facilite l'usinage des pièces en plutonium.
Le plutonium 239 et le plutonium 241 sont des isotopes fissiles par neutrons thermiques, ce qui signifie qu'ils peuvent contribuer à une réaction nucléaire en chaîne et qu'ils peuvent être utilisés dans la conception d'armes nucléaires et de réacteurs nucléaires. Le plutonium 240 présente un taux de fission spontanée très élevé qui impose d'en maintenir un taux inférieur à 7 % dans le plutonium de qualité militaire. Le plutonium 238 a une demi-vie de 88 ans et émet des particules α ; c'est une source de chaleur souvent utilisée par les générateurs thermoélectriques à radioisotopes pour alimenter certaines sondes spatiales en électricité. La séparation des isotopes du plutonium est difficile et ils sont généralement produits spécifiquement par des réacteurs spécialisés. La production de plutonium en quantité suffisante a été l'un des objectifs du projet Manhattan au cours de la Seconde Guerre mondiale afin de développer les premières bombes nucléaires. La première explosion atomique, l'essai Trinity, a utilisé une charge en plutonium, de même que Fat Man, la bombe atomique larguée sur Nagasaki ; la bombe Little Boy larguée trois jours plus tôt sur Hiroshima avait quant à elle un cœur en uranium enrichi.
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC, , 89e éd., p. 10-203
- (en) John W. Arblaster, Selected Values of the Crystallographic Properties of Elements, ASM International, 2018 (ISBN 978-1-62708-155-9).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)