
Back Metaan Afrikaans Metano AN ميثان Arabic Metanu AST Metan Azerbaijani متان AZB Метан Bashkir Metano BCL Метан Byelorussian Мэтан BE-X-OLD
| Metan CH4 | ||||||||
|---|---|---|---|---|---|---|---|---|
 Kalotna molekula
| ||||||||
| IUPAC nomenklatura | metan | |||||||
| Ostala imena | ugljikov tetrahidrid močvarni plin vodikov karbid rudnički plin | |||||||
| Identifikacijski brojevi | ||||||||
| CAS broj | 74-82-8 ✓ | |||||||
| UN broj | 1971 ✓ | |||||||
| RTECS broj | PA1490000 ✓ | |||||||
| EC broj | 200-812-7 ✓ | |||||||
| PubChem broj | 297 ✓ | |||||||
| Osnovna svojstva | ||||||||
| Molarna masa | 16.04 g·mol−1 | |||||||
| Relativna molekulska masa | 16.04 g·mol−1 | |||||||
| Izgled | plin bez mirisa, boje i okusa | |||||||
| Gustoća |
0.42262 g·cm−3 | |||||||
| Talište | 90,7 K -182,5 °C | |||||||
| Vrelište | 111,55 K -161,6 °C | |||||||
| Topljivost u vodi |
22,7 mg·l−1 (20 °C) | |||||||
| Dipolni moment |
0 D | |||||||
| Struktura | ||||||||
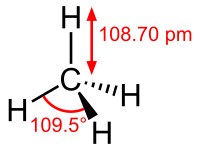 | ||||||||
| Oblik molekule | tetraedarska | |||||||
| Sigurnosne upute | ||||||||
| ||||||||
| Međunarodni sustav mjernih jedinica primijenjen je gdje god je to bilo moguće. Ako nije drugačije naznačeno, upisane vrijednosti izmjerene su pri standardnim uvjetima. | ||||||||
| Portal:Kemija | ||||||||

Metan je bezbojni plin, spoj ugljika i vodika s kemijskom formulom CH4. Spojevi ugljika i vodika nazivaju se ugljikovodici, a metan je najjednostavniji iz te porodice kemijskih spojeva. Razvija se u barama gdje trunu organske tvari pa su ga zvali i močvarni plin. Oslobađa se i u rudnicima ugljena gdje miješanjem sa zrakom stvara eksplozivne smjese koje mogu uzrokovati razorne eksplozije koje su uzrok mnogih rudarskih tragedija.
Kut između kovalentnih veza je 109,5 °. Gorenjem metana, uz prisutnost kisika, nastaje ugljikov dioksid i voda. Veliko obilje metana čini ga vrlo korisnim gorivom. Ipak, jer je metan plin, kod standardnog tlaka i temperature, teško ga je prevesti od nalazišta. Uglavnom se prevozi kroz cjevovode u obliku normalnog plina ili LNG brodovima, koji prevoze ukapljeni zemni plin u tekućem obliku, a vrlo rijetko kamionima.

Metan je prvi otkrio i izdvojio Alessandro Volta između 1776. i 1778., kada je proučavao močvarni plin u jezeru Maggiore, u Italiji.
Metan je vrlo snažan staklenički plin. U usporedbi s CO2 na 20 godina, metan je 72 puta snažniji staklenički plin, a na 100 godina je 25 puta jači.[1] U atmosferi traje oko 10 godina, a nakon toga se razlaže na CO2 i vodu. Metan isto utječe na razlaganje ozonskog omotača.[2] Koncentracija metana u Zemljinoj atmosferi je 1998. godine bila 0,0001745 %, dok je 1750. bila 0,0000700 %. 2008. je koncentracija bila 0,0001800 %, dok je 2010. iznad Arktika izmjereno 0,0001850 %. Znanstvenici su utvrdili da je to najveća koncentracija u zadnjih 400 000 godina. Povijesno, u vrijeme ledenih doba je bila između 0,0000300 % i 0,0000400 %, dok je između ledenih doba normalna vrijednost bila između 0,0000600 % i 0,0000700 %.[3][4][5][6]
Osim toga, postoji velika količina metana u obliku metanskog klatrata ili metanski led, na dnu oceana ispod sedimenata. Prije se vjerovalo da metanski klatrat postoji samo u vanjskim dijelovima Sunčevog sustava. Metanski klatrat je zapravo zaleđena voda koja sadrži u svojoj kristalnoj strukturi veliku količinu metana. Zemljina kora isto sadrži ogromne količine metana. Velike količine metana se stvaraju bez prisutnosti kisika (anaerobno) uz prisutnost mikroba.
Metan se stvara isto u blatnim vulkanima, koji su povezani s dubokim geološkim rasjedima, na odlagalištima otpada, a i u želucima domaćih životinja – preživača, kao što je domaće govedo.
- ↑ IPCC Fourth Assessment Report, Working Group 1, Chapter 2
- ↑ Boucher Olivier, Friedlingstein Pierre, Collins Bill, Shine Keith P.: "The indirect global warming potential and global temperature change potential due to methane oxidation", journal=Environmental Research Letters,2009.
- ↑ Ozon – wpływ na życie człowieka, Ozonowanie/Ewa Sroka, Group: Freony i inne związki, Reakcje rozkładu ozonu. Inačica izvorne stranice arhivirana 1. siječnja 2011. Pristupljeno 17. travnja 2011. journal zahtijeva
|journal=(pomoć) - ↑ Twenty Questions And Answers About The Ozone Layer, UNEP/D.W. Fahey 2002 Arhivirana inačica izvorne stranice od 15. lipnja 2011. (Wayback Machine), pp. 12, 34, 38
- ↑ Carbon Dioxide, Methane Rise Sharply in 2007. Inačica izvorne stranice arhivirana 11. kolovoza 2011. Pristupljeno 17. travnja 2011. journal zahtijeva
|journal=(pomoć) - ↑ Methane seen as growing climate risk

