
Back كتلة ذرية نسبية Arabic Адносная атамная маса Byelorussian Адносная атамная маса BE-X-OLD আপেক্ষিক পারমাণবিক ভর Bengali/Bangla Massa atòmica relativa Catalan Relativní atomová hmotnost Czech Relative atomic mass English Masa atómica relativa Spanish جرم اتمی نسبی Persian Masse atomique relative French
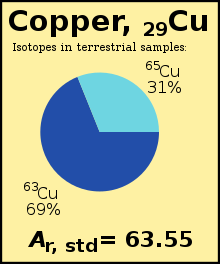
Kebetulan, sumbernya berasal dari lingkungan Bumi kita, dan nilai-nilai ini telah digunakan oleh CIAAW untuk menentukan bobot atom standar tembaga.[1] (Catatan: angka dalam contoh ini disederhanakan)
Massa atom relatif (bahasa Inggris: relative atomic mass, simbol: Ar) atau bobot atom (bahasa Inggris: atomic weight) adalah suatu kuantitas fisik tak berdimensi (angka saja). Dalam definisi modernnya, ia merupakan perbandingan massa rata-rata atom suatu unsur dalam suatu sampel yang diberikan terhadap satu satuan massa atom. Satuan massa atom, simbol u, didefinisikan sebagai 1⁄12 massa satu atom karbon-12.[2][3] Massa atom dapat bervariasi (antara atom dari unsur yang sama), karena adanya berbagai isotop unsur tersebut. Karena kedua nilai dalam rasio tersebut dinyatakan dalam satuan yang sama (u), nilai yang dihasilkan tidak berdimensi; maka nilainya adalah relatif.
Istilah ini biasanya digunakan juga untuk merujuk pada bobot atom relatif yang dipublikasikan secara berkala oleh International Union of Pure and Applied Chemistry (IUPAC).[4][5] Daftar bobot atom standar dapat ditemukan secara meluas dalam buku pelajaran kimia, katalog-katalog komersial, dan papan informasi di laboratorium kimia. Penggunaan kata "berat atom" telah mengundang banyak kontroversi, paling tidak sejak tahun 1960-an[6] (lihat bawah).
Bobot atom, berbeda dengan massa atom (massa atom individu), bukanlah tetapan fisika dan dapat berbeda-beda dari sampel yang satu ke sampel yang lain. Walau demikian, bobot atom cukuplah konstan dalam sampel "normal" untuk digunakan dalam bidang kimia.
- ^ Meija, J.; et al. (2016). "Atomic weights of the elements 2013 (IUPAC Technical Report)". Pure Appl. Chem. 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- ^ International Union of Pure and Applied Chemistry (1980). "Atomic Weights of the Elements 1979" (PDF). Pure Appl. Chem. 52: 2349–84. doi:0033-4545/80/1001-2349$02.00/0 Periksa nilai
|doi=(bantuan). - ^ International Union of Pure and Applied Chemistry (1993). Quantities, Units and Symbols in Physical Chemistry, 2nd edition, Oxford: Blackwell Science. ISBN 0-632-03583-8. p. 41. Electronic version.
- ^ The latest edition is International Union of Pure and Applied Chemistry (2006). "Atomic Weights of the Elements 2005" (PDF). Pure Appl. Chem. 78 (11): 2051–66. doi:10.1351/pac200678112051.
- ^ The updated list of standard atomic weights is expected to be formally published in late 2008. The IUPAC Commission on Isotopic Abundances and Atomic Weights announced Diarsipkan 2009-02-04 di Wayback Machine. in August 2007 that the standard atomic weights of the following elements would be revised (new figures quoted here): lutetium 174.9668(1); molybdenum 95.96(2); nickel 58.6934(4); ytterbium 173.054(5); zinc 65.38(2). The recommended value for the isotope amount ratio of 40Ar/36Ar (which could be useful as a control measurement in argon–argon dating) was also changed from 296.03(53) to 298.56(31).
- ^ de Bièvre, P. (1992). "'Atomic Weight'—The Name, Its History, Definition, and Units" (PDF). Pure Appl. Chem. 64 (10): 1535–43. doi:10.1351/pac199264101535.