
Back Bohrsches Atommodell ALS Modelo atomico de Bohr AN نموذج بور Arabic Modelu atómicu de Bohr AST Bor modeli Azerbaijani Бораўская мадэль атама Byelorussian Модел на Бор Bulgarian বোর মডেল Bengali/Bangla Bohrov model atoma BS Model atòmic de Bohr Catalan
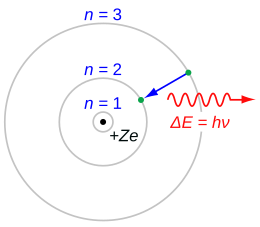
Een elektron (groen balletje hier) springt vanuit een hogere baan (n=3) rond de atoomkern (zwart balletje) naar een lagere baan (n=2). Vanwege behoud van energie wordt het energieverschil ΔE van het elektron in de twee banen uitgezonden als elektromagnetische straling, bijvoorbeeld licht (hier in rood weergegeven). De uitgezonden energie wordt volgens Planck geschreven als de constante van Planck (ℎ) maal de frequentie (ν, bij licht de kleur) van de uitgezonden straling.
Het atoommodel van Bohr is een in 1913 door Niels Bohr geïntroduceerde theorie die de opbouw van atomen beschrijft. Bohr modificeerde het atoommodel van Rutherford door het invoeren van kwantiseringen, gebaseerd op de theorie van Planck over de kwantisering van straling. Het model van Bohr is daarmee het eerste model met kwantumtheoretische aspecten. Voor zijn theorie kreeg Bohr in 1922 de Nobelprijs voor Natuurkunde.
In het atoommodel van Rutherford cirkelen de lichte elektronen als een wolk om een positief geladen zware kern. In de klassieke natuurkunde zenden bewegende ladingen echter elektromagnetische straling uit, zodat het atoom niet stabiel zou zijn. Om aan dit probleem te ontkomen, postuleerde Bohr simpelweg dat de elektronen zich alleen in banen kunnen bevinden op specifieke afstanden van de kern, en dat een elektron in zo'n baan geen straling uitzendt.