
Back Isotoop Afrikaans Isotopo AN نظير (كيمياء) Arabic إيزوطوپ ARY Isótopu AST İzotop Azerbaijani Isotop BAN Isotopo BCL Ізатоп Byelorussian Ізатоп BE-X-OLD
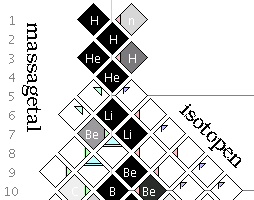
Isotopen zijn atomen van hetzelfde chemische element, dus met hetzelfde aantal protonen, maar met onderling verschillende aantallen neutronen in de atoomkern.
Volgens het gangbare atoommodel bestaat een atoom uit een atoomkern, met een omringende wolk van elektronen. De kern bestaat, per chemisch element, uit een vast aantal protonen, en een variabel aantal neutronen. Het aantal protonen bepaalt het atoomnummer van het element, en zijn chemische eigenschappen. Het aantal neutronen bepaalt onder meer de stabiliteit van de kern en, samen met het aantal protonen, de atoommassa. Twee atomen met evenveel protonen - en dus behorend tot hetzelfde element, en een verschillend aantal neutronen, zijn elkaars isotopen.
'Isotoop' is een samentrekking van het Oudgriekse isos (gelijk) en topos (plaats). Hiermee wordt benadrukt dat alle isotopen van een gegeven chemisch element, dezelfde plaats innemen in het periodiek systeem.