
Back قانون بويل Arabic Llei de Boyle-Mariotte AST Boyl-Mariott qanunu Azerbaijani Закон Бойля-Марыёта Byelorussian Закон на Бойл – Мариот Bulgarian বয়েলের সূত্র Bengali/Bangla Boyle-Mariotteov zakon BS Llei de Boyle Catalan یاسای بۆیڵ CKB Boyleův–Mariottův zákon Czech
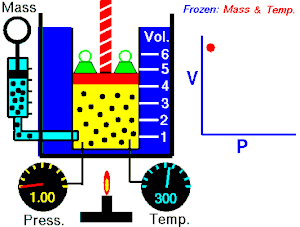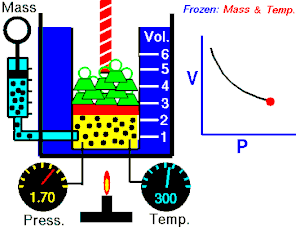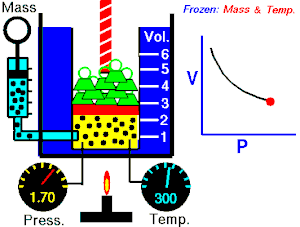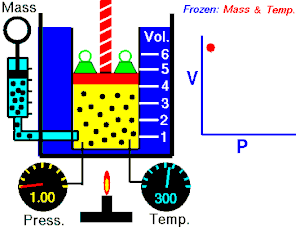
Lei de Boyle-Mariotte (geralmente citada somente como Lei de Boyle) enuncia que a pressão absoluta e o volume de uma certa quantidade de gás confinado são inversamente proporcionais se a temperatura permanece constante em um sistema fechado.[1][2] Em outras palavras, ela afirma que o produto da pressão e do volume é uma constante para uma devida massa de gás confinado enquanto a temperatura for constante. A lei recebe o nome de Robert Boyle, que a publicou em 1662,[3] e de Edme Mariotte, que posteriormente realizou o mesmo experimento e o publicou na França, em 1676, sem ter tido conhecimento dos trabalhos de Boyle.
Segundo a lei enunciada pelos dois cientistas: em um gráfico pressão x volume, sob uma temperatura constante, o produto entre pressão e volume deveria ser constante, se o gás fosse perfeito. Existe uma temperatura em que o gás real aparentemente obedece à lei de Boyle-Mariotte. Esta temperatura é chamada de temperatura de Mariotte.
- ↑ Levine, Ira. N (1978). "Physical Chemistry" University of Brooklyn: McGraw-Hill
- ↑ Levine, Ira. N. (1978), p12 gives the original definition.
- ↑ J Appl Physiol 98: 31-39, 2005. Free download at Jap.physiology.org
