
Back Isotoop Afrikaans Isotopo AN نظير (كيمياء) Arabic إيزوطوپ ARY Isótopu AST İzotop Azerbaijani Isotop BAN Isotopo BCL Ізатоп Byelorussian Ізатоп BE-X-OLD
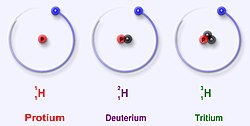
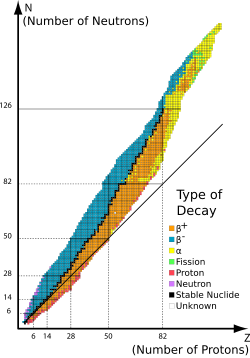
En isotop av ett grundämne är en variant med ett specifikt antal neutroner. Atomslaget bestäms av antalet protoner i kärnan, atomnumret, och är avgörande för elektronkonfigurationen, och därmed de kemiska egenskaperna hos ett ämne. I kärnan finns också för de flesta grundämnen neutroner, som påverkar de kemiska egenskaperna i långt mindre grad. Olika isotoper av samma ämne har därför vanligen nästan helt identiska kemiska egenskaper, även om masstalet skiljer.
Skillnaderna i masstal kan dock innebära att vissa fysikaliska egenskaper, som densitet, smältpunkt och kokpunkt, är olika. För väte, där atommassan är låg från början, påverkar också skillnaden i massa mellan vanligt och tungt väte de kemiska egenskaperna något. Dessutom varierar atomkärnans stabilitet kraftigt mellan olika isotoper, varför man vanligen bara kan hitta ett fåtal olika isotoper av ett ämne i naturen. Andra isotoper kan skapas i laboratorier, men är då radioaktiva.
För lättare atomslag är antalet neutroner i kärnan ungefär lika med antalet protoner. Tyngre grundämnen har en högre andel neutroner vilket ses i nuklidkartan.
Ordet isotoper används ibland oegentligt i stället för nuklider.[1] Begreppet nuklid syftar i första hand på nukleära egenskaper framför kemiska egenskaper, medan begreppet isotop främst syftar på kemiska egenskaper framför nukleära. När man fokuserar på en bestämd typ av atomkärna och dess egenskaper, till exempel i kärnreaktioner, väljer man lämpligast nuklid. När det handlar om att gruppera olika slags atomer av ett visst grundämne är isotop det mer adekvata begreppet.
Som exempel visar nuklidkartan att grundämne nummer 50 – tenn - har 7 stabila isotoper (svarta rutor) och ytterligare 31 instabila isotoper (orange och blå rutor). Kartan visar också att det finns 3 stabila nuklider (88Sr, 89Y och 90Zr) med neutronantalet 50. För de två sistnämnda finns det dock även de radioaktiva kärnisomererna 89mY och 90mZr vilka inte markeras i kartan.
- ^ Hägg, G. 1963, Allmän och oorganisk kemi, Almqvist & Wiksell Uppsala, avsnitt 1-3c sid 23