
Back Kwik Afrikaans ባዜቃ Amharic Mercurio (elemento) AN زئبق Arabic زاواق ARY زيبق ARZ Mercuriu (elementu) AST Civə Azerbaijani جیوه AZB Терегөмөш Bashkir
| Mercuri | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
80Hg
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Platejat Línies espectrals del mercuri | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Mercuri, Hg, 80 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls de transició | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 12, 6, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 200,59(2) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Xe] 4f14 5d10 6s2 2, 8, 18, 32, 18, 2 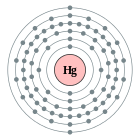
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Líquid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
13,534 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 234,32 K, −38,83 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 629,88 K, 356,73 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt crític | 1.750 K, 172,00 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 2,29 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 59,11 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 27,983 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 4, 2 (mercúric), 1 (mercurós) (òxid bàsic feble) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 2,00 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització | 1a: 1.007,1 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 1.810 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3a: 3.300 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 151 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 132±5 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi de Van der Waals | 155 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Romboèdrica 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Diamagnètic[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (25 °C) 961nΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 8,30 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 60,4 µm·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so | (líquid. 20 °C) 1.451,4 m·s−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7439-97-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del mercuri | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El mercuri és l'element químic de símbol Hg i nombre atòmic 80. Té un nombre màssic de 201, és a dir, el seu nucli conté 80 protons i 121 neutrons. És un metall que es presenta en forma líquida[2] i pertany als metalls de transició. Se'l coneix igualment com a argent viu[3] i hidrargir.[4] El seu nom i símbol químic, Hg, procedeixen del llatí hydrargyrum, és a dir, argent líquid, el seu nom i símbol fan referència al seu aspecte argentat i a la seva forma líquida[5]. El nom llatí prové del grec ὑδράργυρος (hidràrgiros), dels mots hidro, que vol dir ‘aigua’, i argiros, ‘argent’.
El mercuri apareix en dipòsits a tot el món, principalment com a cinabri (sulfur de mercuri). El pigment vermell denominat vermelló s'obté triturant cinabri natural o sulfur de mercuri obtingut per síntesi.
El mercuri s'usa en termòmetres, baròmetres, manòmetres, esfigmomanòmetres, alguns tipus de vàlvules com les bombes de buit, els interruptors de mercuri, les làmpades fluorescents i altres dispositius, malgrat que la preocupació sobre la toxicitat de l'element ha portat els termòmetres i tensiómetres de mercuri a ser eliminats en gran manera en entorns clínics en favor d'altres alternatives, com els termòmetres de vidre que utilitzen alcohol o galinstà, els termistors o els instruments electrònics basats en el mesurament de la radiació infraroja. De la mateixa manera, manòmetres mecànics i sensors de calibradors de tensió electrònics han substituït els esfigmomanòmetres de mercuri. El mercuri es manté en ús en aplicacions d'investigació científica i en amalgames odontològiques, encara utilitzades en alguns països. També s'utilitza en els llums fluorescents, en què l'electricitat que travessa un llum que conté vapor de mercuri a baixa pressió produeix radiació ultraviolada d'ona curta, que al seu torn provoca la fluorescència del fòsfor que recobreix el tub, produint llum visible.
L'enverinament per mercuri pot resultar de l'exposició a les formes solubles en aigua del mercuri (com el clorur mercúric o el metilmercuri), per la inhalació de vapor de mercuri, o per la ingestió de qualsevol de les formes.
- ↑ "Magnetic susceptibility of the elements and inorganic compounds" a Lide, D. R. CRC Handbook of Chemistry and Physics (en anglès). 86a edició. CRC Press, 2005. ISBN 0-8493-0486-5.
- ↑ «mercuri». Diccionari de la llengua catalana de l'IEC. Institut d'Estudis Catalans.
- ↑ «argent». Diccionari de la llengua catalana de l'IEC. Institut d'Estudis Catalans.
- ↑ «hidrargir». Diccionari de la llengua catalana de l'IEC. Institut d'Estudis Catalans.
- ↑ Newton, 2010, p. 341.