
Back Isotoop Afrikaans Isotopo AN نظير (كيمياء) Arabic إيزوطوپ ARY Isótopu AST İzotop Azerbaijani Isotop BAN Isotopo BCL Ізатоп Byelorussian Ізатоп BE-X-OLD
Isotop adalah dua atau lebih jenis atom yang memiliki nomor atom (jumlah proton dalam inti mereka) yang sama dan posisi dalam tabel periodik (dan karenanya termasuk dalam unsur kimia yang sama), dan yang berbeda dalam nomor nukleon (nomor massa) karena untuk jumlah neutron yang berbeda dalam inti mereka. Walaupun semua isotop dari unsur tertentu memiliki sifat kimia yang hampir sama, mereka memiliki massa atom dan sifat fisik yang berbeda.[1]
Istilah isotop dibentuk dari akar kata Yunani isos (ἴσος "sama") dan topos (τόπος "tempat"), yang berarti "tempat yang sama"; dengan demikian, makna di balik nama tersebut adalah bahwa isotop yang berbeda dari suatu unsur menempati posisi yang sama pada tabel periodik.[2] Istilah ini diciptakan oleh dokter dan penulis Skotlandia Margaret Todd pada tahun 1913 dalam sebuah usul kepada ahli kimia Inggris Frederick Soddy.[3]
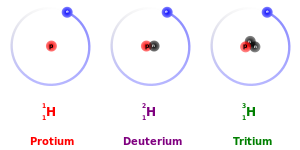
Jumlah proton dalam inti atom disebut nomor atom dan sama dengan jumlah elektron dalam atom netral (tidak terionisasi). Setiap nomor atom mengidentifikasi unsur tertentu, tetapi bukan isotopnya; sebuah atom dari unsur tertentu mungkin memiliki kisaran jumlah neutron yang luas. Jumlah nukleon (proton dan neutron) dalam inti adalah nomor massa atom, dan setiap isotop unsur tertentu memiliki nomor massa yang berbeda.
Misalnya, karbon-12, karbon-13, dan karbon-14 adalah tiga isotop dari unsur karbon dengan nomor massa masing-masing 12, 13, dan 14. Nomor atom karbon adalah 6, yang artinya setiap atom karbon memiliki 6 proton, sehingga jumlah neutron dari isotop-isotop tersebut adalah 6, 7, dan 8, berturut-turut.
- ^ Herzog, Gregory F. (2 Juni 2020). "Isotope". Encyclopædia Britannica.
- ^ Soddy, Frederick (12 Desember 1922). "The origins of the conceptions of isotopes" (PDF). Nobelprize.org. hlm. 393. Diakses tanggal 20 Juli 2022.
Jadi unsur-unsur yang identik secara kimia - atau isotop, sebagaimana saya menyebutnya untuk pertama kalinya dalam surat ini kepada Nature, karena mereka menempati tempat yang sama dalam Tabel Periodik ...
- ^ "isotope—Origin and meaning". www.etymonline.com (dalam bahasa Inggris). Diakses tanggal 20 Juli 2022.